Adénocarcinome pancréatique : diagnostic, bilan d’extension, prise en charge et résultats oncologiques.
Auteur : Catherine Hubert, MD, PhD
Unité de chirurgie hépato-bilio-pancréatique
Service de chirurgie et de transplantation abdominale
Groupe des tumeurs hépato-bilio-pancréatiques Institut Roi Albert II, Cliniques universitaires St Luc
En association avec nos hôpitaux partenaires : Clinique St Jean (Bruxelles), Clinique St Pierre (Ottignies), Clinique ND de Grâce (Gosselies)
Introduction
Le terme « cancer du pancréas » regroupe différentes tumeurs au comportement et au pronostic variés. On peut les séparer en deux groupes distincts : les tumeurs neuro-endocrines, issues des îlots de Langerhans et les cancers issus des cellules pancréatiques canalaires dont l’Adénocarcinome est de loin le plus fréquent puisqu’il représente 80% des cas (1). Sa prévalence est de 1 à 10 pour 100000 habitants, touchant plus fréquemment les hommes. L’âge médian se situe aux alentours de 70 ans. Les principaux facteurs de risque sont le tabac, le diabète, l’obésité et la pancréatite chronique. La présence d’antécédents familiaux n’est retrouvée que dans 5-10% des cas (2). Le pronostic de l’adénocarcinome pancréatique va dépendre de son stade qui est corrélé à l’extension tumorale locale (stade « T »), à l’extension ganglionnaire (stade « N ») et à la présence ou non de métastases (stade « M ») (table 1). Selon les données récentes de l’American Cancer Society, la survie à 5 ans est de 37% si la tumeur est localisée, sans dissémination ganglionnaire, de 12% si des ganglions locaux sont envahis et de seulement 3% en présence de métastases à distances. L’adénocarcinome pancréatique métastase préférentiellement dans le foie, le péritoine et les ganglions (3).
Diagnostic
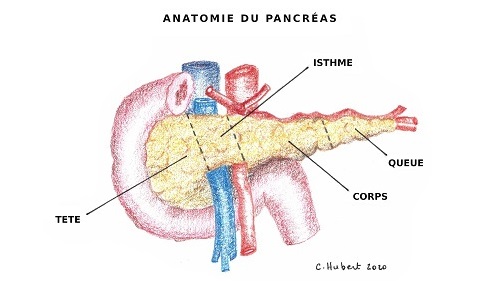
Le pancréas est constitué de plusieurs parties : la tête, l’isthme, le corps et la queue (Figure 1).
Les symptômes les plus fréquemment rencontrés sont une perte de poids, des douleurs abdominales, une asthénie, une perte d’appétit, l’apparition d’un diabète et un ictère (ce dernier symptôme ne survient que si la tumeur est localisée dans la tête du pancréas, en raison de l’envahissement de la voie biliaire). Le médecin généraliste est très souvent le premier à être consulté par le patient. En l’absence d’ictère, le diagnostic peut s’avérer difficile en raison du peu de spécificité des symptômes et de la relative rareté de ce cancer. Cependant, le diagnostic précoce est un élément clé pour le pronostic du patient. L’apparition d’une altération de l’état général, d’un diabète de « novo », de douleurs épigastriques ou encore d’un ictère doivent donc être investigués rapidement.
Quel bilan réaliser ?
La biologie peut mettre en évidence une augmentation du CEA et du CA19.9. Ce dernier que l’on retrouve souvent dans les tumeurs de la tête du pancréas peut cependant être faussement élevé en cas de cholestase. Le scanner abdominal coupes fines et avec phases artérielle et portale permet de mettre en évidence la plupart des tumeurs pancréatiques. Un bilan d’extension comportant une écho-endoscopie avec cytoponction et un Pet CT FDG vont permettre de stadifier la tumeur. Le dossier est alors discuté en réunion pluridisciplinaire d’oncologie dans un centre accrédité en chirurgie pancréatique comportant un groupe d’experts de chaque spécialité impliquée dans le diagnostic et dans le traitement qui vont stadifier la tumeur et déterminer le traitement le plus adéquat en fonction de son étendue. En cas d’ictère et de cholestase sévère, il est préférable de drainer la voie biliaire par une endoprothèse. En ce qui concerne la stratégie thérapeutique, il y a globalement trois cas de figures possible :
- 1. La tumeur est associée à des métastases,
- 2. la tumeur n’est pas métastatique mais elle est trop étendue que pour pouvoir être opérée d’emblée (tumeur localement avancée)
- 3. La tumeur est opérable d’emblée.
Si la tumeur est associée à des métastases, le traitement ne pourra pas être curatif et consistera le plus souvent en une chimiothérapie palliative. Le patient sera vu en consultation par un médecin oncologue qui lui expliquera le type de chimiothérapie proposée, les modalités du traitement ainsi que les effets secondaires de celui-ci. Plusieurs molécules peuvent être administrées (combinaison d’Oxaliplatine et d’Irinotécan, Gemcitabine, Abraxane) ; le choix du traitement se fera en fonction de l’âge, de l’état général et de la comorbidité du patient (4). L’immunothérapie n’occupe actuellement qu’une place marginale dans le traitement car elle impose, pour être efficace, que l’ADN de la cellule tumorale présente une instabilité des microsatellites (MSI) que l’on ne retrouve que chez 1% des patients atteints de cancer pancréatique.
Si la tumeur est « localement avancée », généralement car elle est en contact avec de gros vaisseaux digestifs tels que le confluent veineux porto-mésentérique, l’artère mésentérique ou le tronc cœliaque ; on propose alors un traitement néoadjuvant. Il s’agit d’un traitement de chimiothérapie ou de radio-chimiothérapie administré en vue d’obtenir une réduction tumorale significative de manière à ce que la tumeur devienne opérable (4).
Si la tumeur est opérable d’emblée, on propose alors une intervention chirurgicale. Le patient est vu en consultation par un chirurgien qui va lui expliquer les détails de l’intervention, les complications possibles, la durée d’hospitalisation, …
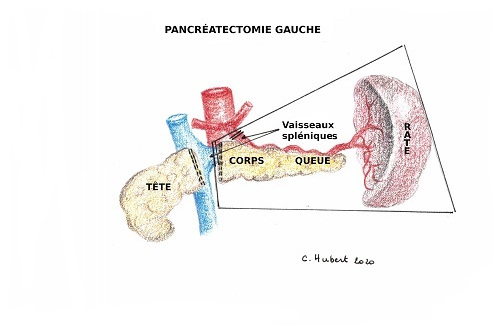
L’intervention chirurgicale va être très différente si la tumeur est localisée dans la tête et l’isthme du pancréas (partie droite du pancréas) ou si elle est située dans le corps ou la queue du pancréas (partie gauche) (5).
Les tumeurs situées dans la partie gauche vont faire l’objet de l’ablation du corps et la queue du pancréas et souvent de la rate (splénectomie)-(Figure 2).
Cette intervention de lourdeur modérée peut être réalisée dans une grande majorité des cas par laparoscopie.
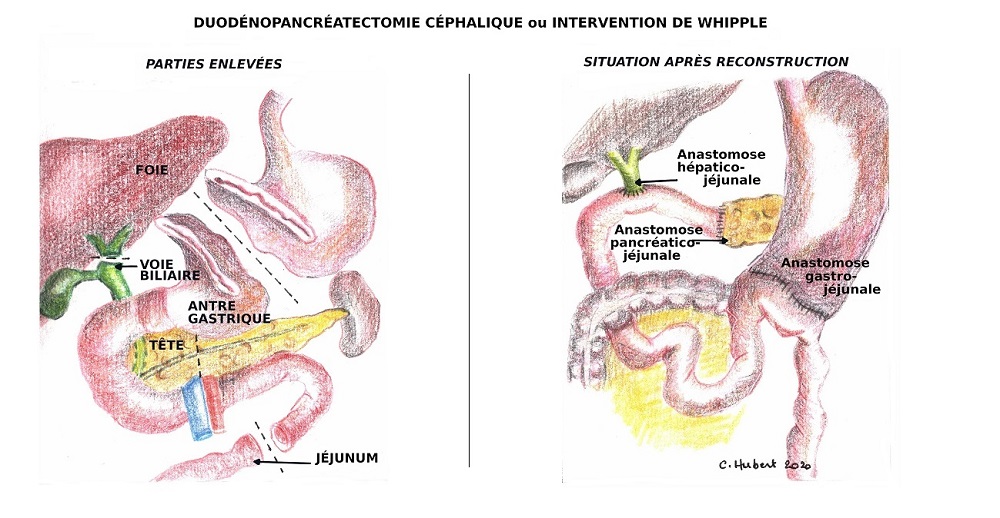
A l’inverse, les tumeurs situées dans la tête du pancréas devront faire l’objet d’une intervention beaucoup plus lourde qui s’appelle « Duodénopancréatectomie céphalique » ou intervention de WHIPPLE (nom du chirurgien qui a fait cette intervention pour la première fois en 1935). La tête du pancréas étant insérée dans le cadre duodénal et étant traversée par le canal biliaire, il n’est pas possible de n’enlever que la tête du pancréas. L’intervention de WHIPPLE va consister en l’ablation du cadre duodénal et souvent de l’antre gastrique, des 15 premiers centimètres de l’intestin grêle, de la voie biliaire et la vésicule (Figure 3A). Il faut ensuite réaliser une reconstruction du système digestif nécessitant plusieurs anastomoses : la première sur le pancréas, la deuxième sur la voie biliaire et la troisième sur l’estomac (Figure 3B).
Résultats oncologiques et suivi
Depuis le 1er juillet 2019, la chirurgie pancréatique se doit d’être réalisée dans des centres qui ont été accrédités par l’INAMI sur base de leur expertise fondée notamment sur leurs résultats antérieurs (nombre de patients opérés, mortalité et morbidité post-opératoire). Dans notre institution, la mortalité péri-opératoire à 1 mois est de 2,8 % et à 3 mois de 5,7%. Les données provenant du registre national belge du cancer montrent que la mortalité péri-opératoire nationale moyenne à 1 mois et à 3 mois est de 3,9 % et 7,8 %, respectivement. Les centres accrédités doivent avoir une équipe pluridisciplinaire spécialisée en pathologie pancréatique qui comporte au minimum 2 chirurgiens spécialisés, des radiologues et radiologues interventionnels, nucléaristes, oncologues, gastro-entérologues endoscopistes, anatomo-pathologistes, radiothérapeutes, intensivistes et anesthésistes.
Cette prise en charge pluridisciplinaire est un élément clé pour obtenir les meilleurs résultats oncologiques. Les patients opérés d’un cancer pancréatique auront, après l’intervention, une chimiothérapie adjuvante même si la résection est complète car la combinaison de la chirurgie et de la chimiothérapie donne des taux de survie significativement meilleurs par rapport à la chirurgie seule. Une étude publiée en 2018 dans le New England Journal of Medicine a montré que les patients opérés qui reçoivent une chimiothérapie par Folfirinox ont une survie globale à 3 ans de 63% (6).
Qu’ils soient traités par chimiothérapie exclusive ou opérés, l’impact psychologique de ces traitements lourds est majeur, d’autant plus qu’ils se surajoutent à un diagnostic déjà difficile à accepter. De plus, les patients opérés peuvent développer un diabète et la majorité présentera une insuffisance pancréatique exocrine qui nécessitera la prise de Créon. Après le traitement, le rôle du médecin traitant sera donc primordial dans le suivi ambulatoire. Personne de référence et de confiance du patient et de sa famille, il est le lien entre le patient et l’équipe hospitalière à qui il l’a confié.
Références
- Winter JM et al. 1423 pancreatico-duodenectomies for pancreatic cancer: a single-institution experience. JGastroIntest Surg 2006; 10: 1199-1210
- Teiblum S. et al.Sixty one years of pancreatic cancer in Denmark from 1943 to 2003. Pancreas 2009; 38:374-78
- TNM classification; 8th UICC Edition
- Guidelines Pancreatic Adenocarcinoma NCCN Clinical Practice Guidelines in Oncology a 2019
- Ducreux M. et al. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals Oncology 2015; 26(5): P12
- Conroy T. et al. N Engl JMed 2018; 379:2395-2406
- Cancer du pancréas, Monographie de L’AFC 2010
Table 1
TNM classification of pancreatic adenocarcinoma)
Union for international cancer control (UICC)
(8th edition)
Primary tumor staging (T)
- Tx, T0, Tis: see TNM system
- T1: tumor ≤ 2 cm in greatest dimension
- T2: tumor >2 cm in greatest dimension but less than ≤ 4 cm
- T3: tumor >4 cm in greatest dimension
- T4: involvement of SMA or celiac axis
Regional lymph nodes (N)
- Nx: nodes cannot be assessed
- N0: no evidence of nodal involvement
- N1: 1-3 regional node metastases present
- N2: 4 or more regional node metastases present
Metastases (M)
- Mx: presence of metastases cannot be assessed
- M0: no evidence of metastases
- M1: distant metastases present
Stage groupings
- stage 0: Tis N0 M0
- stage Ia: T1 N0 M0
- stage Ib: T2 N0 M0
- stage IIa: T3 N0 M0
- stage IIb: T1, T2 or T3 with N1 M0
- stage III: any T N2 M0, or T4 any N
- stage IV: M1 (any T any N)
