Le cancer de l’œsophage : Diagnostic et bilan d’extension
Groupe FOREGUT, Institut Roi Albert II, Cliniques universitaires Saint-Luc
VAN DEN EYNDE Marc, Oncologie médicale ; DE CUYPER Astrid, Oncologie médicale ; VAN OOTEGHEM Geneviève, Radiothérapie oncologique ; DEPREZ Pierre, Hépato-gastro-entérologie ; DRAGEAN Cristina Anca, Radiologie ; DANO Hélène, Anatomopathologie ; THOMA Maximilien, Chirurgie Oeso-gastrique ; DESWYSEN Yannick, Chirurgie Oeso-gastrique.
Avec la collaboration des institutions partenaires : Clinique Saint-Jean (Bruxelles), Clinique de l’Europe (Bruxelles), Clinique Saint-Pierre (Ottignies), Clinique Notre-Dame de Grâce (Gosselies)
Dans nos contrées occidentales, l’incidence actuelle du cancer de l’œsophage reste stable. Il est le 15ème cancer en fréquence en Belgique, touchant préférentiellement les hommes entre 60 et 80 ans, et le 3ème cancer digestif assez loin derrière le cancer colorectal.
Il existe différents types de cancers œsophagiens : le carcinome épidermoïde, situé le plus souvent dans la partie supérieure et moyenne de l’œsophage, et l’adénocarcinome, développé dans le bas œsophage à partir des cellules glandulaires. Les facteurs de risque sont bien connus. Le carcinome épidermoïde est favorisé par l’alcool et le tabac. L’adénocarcinome se développe quant à lui sur une métaplasie glandulaire intestinale (œsophage de Barrett) et est lié au reflux œsophagien et à une surcharge pondérale favorisant ce reflux. Il est actuellement plus fréquent en Belgique que le carcinome épidermoïde, dont l’incidence décroît.
Le risque de transformation néoplasique d’un œsophage de Barrett est de 0.2-0.5% par an, lorsqu’aucune cellule anormale (dysplasie) n’est présente. Il est de 2,5 % en cas de dysplasie de bas grade et s’élève à près de 25 % par an en cas de dysplasie de haut grade. Ces données justifient le dépistage endoscopique et le suivi de l’œsophage de Barrett, selon les recommandations internationales.
Le pronostic et le traitement du cancer de l’œsophage sont essentiellement liés à l’extension locale de la tumeur (stade « T »), à l’existence d’un envahissement ganglionnaire (stade « N » pour node) et à la présence de métastases (stade « M »).
Diagnostic du cancer de l’œsophage
Le cancer peut être détecté à un stade débutant lors d’une endoscopie pour un problème de reflux ou dans un contexte de dépistage, mais le plus souvent, il est diagnostiqué en raison de symptômes de dysphagie progressive et persistante, et d’une perte de poids.
La perte d’appétit, la fatigue et l’altération de l’état général accompagnent souvent le tableau clinique.Ces symptômes amènent le patient à consulter son médecin généraliste.
Toute dysphagie représente un signal d’alarme nécessitant une endoscopie digestive haute qui permettra de réaliser des biopsies et de préciser le diagnostic et la localisation de la tumeur dans l’œsophage (Figure 1A).
Les endoscopes de haute résolution et l’utilisation de la chromoendoscopie (coloration de la muqueuse) permettent le diagnostic et la classification des lésions superficielles de l’œsophage.
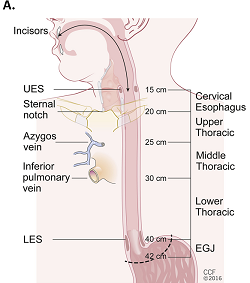
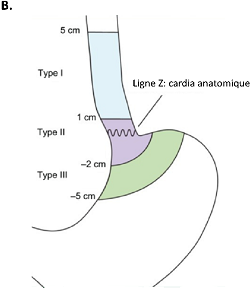
La localisation exacte de la tumeur est importante pour la prise en charge thérapeutique. La classification de Siewert (Figure 1B) est utilisée pour les adénocarcinomes de la jonction oeso-gastriques.
Une tumeur de type Siewert 1 et 2 bénéficie d’une prise en charge apparentée à celle d’une tumeur de l’œsophage, alors qu’une tumeur de Siewert 3 bénéficie d’une prise en charge apparentée à celle des cancers de l’estomac.
Figure 1: Localisation de la tumeur (A) et classification de Siewert pour les adénocarcinomes de la jonction oeso-gastriques (B) ; (UES : sphincter oesophagien supérieur, LES : sphincter oesophagien inférieur, EGJ : eso-gastric junction).
Quel bilan pré-thérapeutique réaliser ?
Une fois le diagnostic posé, un bilan complémentaire est rapidement organisé en centre spécialisé pour caractériser et stadifier la tumeur (Figure 2). Il comporte :
- un scanner cervico-thoraco-abdominal injecté qui évalue l’extension de la tumeur aux ganglions, aux organes de voisinage et à distance
- une échoendoscopie haute qui visualise le mieux les différentes couches de la paroi de l’œsophage et les ganglions para-tumoraux, et permet un bilan plus précis de l’envahissement loco-régional
- un PET-scanner (FDG) qui évalue l’extension ganglionnaire et détecte la présence éventuelle de métastases à distance
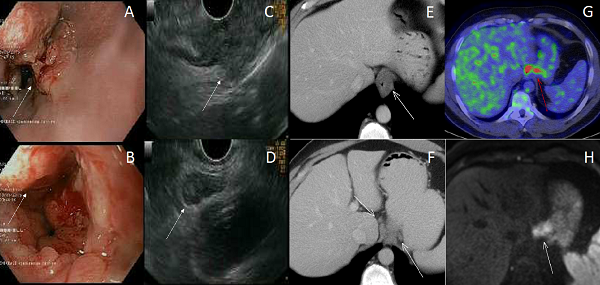
Figure 2: Patient de 42 ans, présentant une dysphagie et un amaigrissement significatif. Le bilan révèle une tumeur du bas œsophage, Siewert 2, stadifiée cT3N1M0.
A-B: Gastroscopie mettant en évidence une tumeur sub-sténosante (A) du bas œsophage entreprenant la jonction oeso-gastrique (B)
C-D: Echoendoscopie stadifiant la tumeur uT3: envahissement de l’ensemble de la paroi de l’œsophage (C), uN1: ganglion suspect para-tumoral (D)
E-F: Scan cervico-thoraco-abdomino-pelvien injecté retrouvant un épaississement suspect du bas œsophage (E) avec plusieurs ganglions para-tumoraux suspects (F), sans métastases à distance
G-H: FDG PET-scan confirmant une fixation métabolique suspecte au niveau tumoral et ganglionnaire (G). IRM abdominale supérieure (réalisée ici pour exclure la présence de micro-métastases hépatiques) et montrant la tumeur en séquence de diffusion (H).
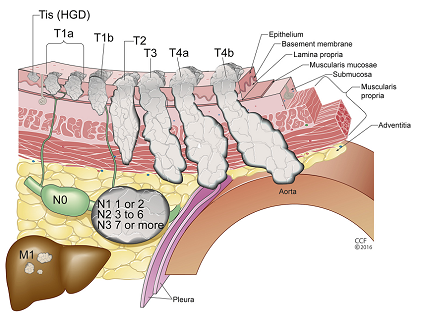 Au terme de ce bilan, une Concertation Multidisciplinaire Oncologique réunissant les différents acteurs de la prise en charge du cancer de l’œsophage a lieu en centre expert. Lors de cette discussion, la lésion est stadifiée selon la classification clinique TNM (Figure 3) et un plan de traitement est alors proposé.
Au terme de ce bilan, une Concertation Multidisciplinaire Oncologique réunissant les différents acteurs de la prise en charge du cancer de l’œsophage a lieu en centre expert. Lors de cette discussion, la lésion est stadifiée selon la classification clinique TNM (Figure 3) et un plan de traitement est alors proposé.
Figure 3 : Stadification clinique TNM : « T : tumor, N : node, M : metastasis ».
Celle-ci est indispensable pour déterminer le traitement à proposer au patient ; (HGD : dysplasie de haut grade).
Lorsqu’une proposition de traitement à visée curative est retenue, un complément de bilan est souvent demandé afin de rechercher d’éventuelles tumeurs synchrones et de confirmer la résécabilité de la tumeur. Celui-ci peut comporter :
- Une évaluation de la résécabilité de la lésion par endoscopie (mucosectomie en cas de cancer superficiel)
- Une évaluation de la résécabilité et de l’opérabilité du patient par un chirurgien expérimenté, membre d’une équipe chirurgicale accréditée en chirurgie œsophagienne
- Une consultation auprès d’un anesthésiste expert dans la prise en charge de ces tumeurs
- Une fibroscopie bronchique qui sera systématiquement réalisée en cas de cancer épidermoïde ou de doute sur un contact tumoral avec l’arbre trachéo-bronchique
- Un examen ORL incluant une nasofibroscopie en cas de cancer épidermoïde
- Une évaluation de la fonction respiratoire et cardiaque
- Une évaluation nutritionnelle et suivi diététique
- Une coelioscopie exploratrice à la recherche de métastases péritonéales occultes (non révélées à l’imagerie) pour les adénocarcinomes de la jonction oeso-gastrique.
Support nutritionnel
Une dénutrition est souvent associée au cancer de l’œsophage (jusqu’à 80% des patients). Elle augmente le risque de morbidité (défaut de cicatrisation, propension plus élevée aux infections, riposte insulinique inadaptée, …) et de mortalité de la chirurgie, mais a aussi un impact important sur les traitements de chimiothérapie et radiothérapie.
En cas de cancer digestif haut, la détection de la dénutrition doit être réalisée le plus précocement possible dans la mesure où :
- Les traitements de chimiothérapie et de radiothérapie peuvent eux-mêmes aggraver cet état de dénutrition
- Il est possible de la corriger de façon efficace et d’améliorer ainsi non seulement les résultats opératoires mais également le pronostic à long terme
Une prise en charge nutritionnelle personnalisée permet de limiter le risque de dénutrition et ses conséquences. Il peut s’agir de conseils pratiques pour améliorer les prises alimentaires au quotidien ou, si nécessaire, d’une aide médicale à l’alimentation par support nutritionnel (compléments nutritifs oraux, jéjunostomie ou gastrostomie).
Rôle du médecin généraliste
Le médecin généraliste est souvent le premier professionnel de santé contacté par le patient dans le cadre d’un tableau clinique de dysphagie, de perte de poids ou d’altération de l’état général. Il est donc un intervenant essentiel qui facilitera le diagnostic précoce de ce cancer.
En outre, le Médecin généraliste assure également un rôle primordial dans le soutien au patient durant toute la prise en charge de sa maladie. En assurant le lien avec le milieu hospitalier, il reste indéniablement la personne de référence et de confiance du patient lors de la discussion de son traitement et sa gestion en dehors de l’hôpital.
Références
1. https://kankerregister.org/Statistieken_tabellen_jaarbasis (C15)
2. T. Rice et al. Cancer of the esophagus and Esophagogastric junction: an eight edition staging primer. J Thorac Oncol. 2017 Jan;12(1):36-42.
3. Lordick et al. Oesophageal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 27 (Supplement 5): v50–v57, 2016
